Publikacja nt. homeostazy naskórka
30.06.2023
Naukowcy Międzyuczelnianego Wydziału Biotechnologii UG i GUMed opublikowali pracę badawczą dotyczącą mechanizmu zapewniającego homeostazę naskórka i tworzenie skutecznej bariery skóry w czasopiśmie naukowym Journal of Extracellular Vesicles. Pierwszym autorem publikacji jest mgr Adrian Kobiela – doktorant studiów LiSMIDoS z Pracowni Immunologii Doświadczalnej i Translacyjnej MWB, natomiast autorem korespondencyjnym jest dr hab. Danuta Gutowska-Owsiak, prof. UG, kierująca jednostką.
W gronie autorów Gdański Uniwersytet Medyczny reprezentowali: prof. Magdalena Trzeciak z Katedry i Kliniki Dermatologii, Wenerologii i Alergologii GUMed, prof. Michał Pikuła i dr inż. Milena Deptuła z Zakładu Embriologii GUMed. Współautorami pracy są również obecni i byli pracownicy Pracowni Immunologii Doświadczalnej i Translacyjnej MWB: dr Lilit Hovhannisyan, mgr Paulina Jurkowska, mgr Argho Aninda Paul, mgr Kinga Panek i dr Ewa Czechowska. W badaniach uczestniczyli też inni pracownicy z Wydziału: dr hab. inż. Aleksandra Królicka, prof. UG, dr Michał Rychłowski, dr Aleksandra Bogucka. Praca ta powstała przy współpracy z University of Oxford, Karolinska Institutet oraz Imperial College London.
Opisany w publikacji mechanizm pokazuje, że komórki naskórka (keratynocyty) uwalniają małe sekrecyjne pęcherzyki (ang. small extracellular vesicles, sEV), które wykorzystują do eliminacji nadmiaru białka filagryny z cytoplazmy. Filagryna jest białkiem istotnym dla funkcjonowania bariery skóry, ponieważ bezpośrednio wzmacnia ją mechanicznie, a pośrednio umożliwia utrzymywanie wody i zapobiega parowaniu, ma również działanie antybakteryjne i immunosupresyjne. Rola tego białka jest ogromna, co wyraźnie widać w przypadku pacjentów z atopowym zapaleniem skóry (AZS), u których często obserwuje się mutację w kodującym je genie.
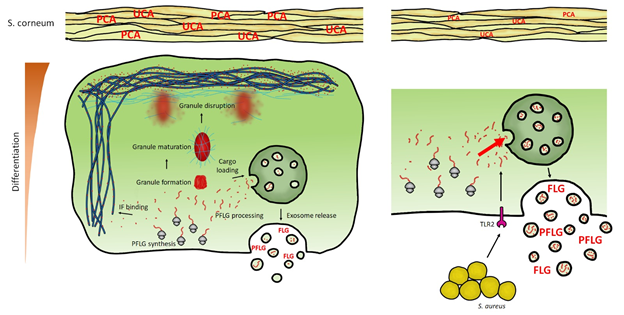
Pomimo pozytywnej roli filagryny, nagromadzenie jej w cytoplazmie w formie niezwiązanej ma działanie cytotoksyczne, co indukuje śmierć komórki. Mechanizm ten jest niezbędny podczas powstawania warstwy rogowej. Poziom filagryny musi być ściśle kontrolowany w jego dolnych warstwach, by zabezpieczyć przed przedwczesną śmiercią komórek i umożliwić powstanie wielowarstwowej tkanki. Badacze wykazali, że eliminacja nadmiaru białka poprzez transport pęcherzykowy jest krytyczna, a blokowanie produkcji sEV i eliminowania niezwiązanej filagryny ma szkodliwy wpływ na keratynocyty.
Co więcej, w trakcie badań okazało się, że gronkowiec złocisty (S. aureus) nasila transport pęcherzykowy, by zwiększyć usuwanie filagryny ze skóry. Mechanizm ten ma znaczenie zwłaszcza u pacjentów z AZS, gdzie kolonizacja tą bakterią jest częsta, a ilość filagryny w naskórku jest obniżona. Naukowcy sugerują, że bakteria może nasilać niedobór, by ograniczać rolę przeciwbakteryjną tego białka i zwiększać szanse swojego przetrwania na skórze chorego.
– Jest to potencjalny nowy cel terapeutyczny w chorobie – przekonują autorzy publikacji.
fot. FP_atkwork/Freepik, archiwum prywatne